24小时服务热线殷女士18971342092
Email电子邮箱1241563128@qq.com
公司地址武汉市蔡甸区经济技术开发区东风三路1号-东合中心H座
脊髓损伤 | 开放型急性脊髓损伤模型 | 大鼠 |
闭合型急性脊髓损伤模型 | 大/小鼠 | |
慢性缺血性脊髓损伤 | 大鼠/兔 |
急性脊髓损伤(ASCI)小鼠模型的建模方法
模式动物品系:SPF级ICR小鼠,健康,雄性,8~12W
实验分组:实验分六组:正常对照组、模型组、阳性药组、受试药组三个剂量组。
实验周期:4-6 weeks
建模方法:
取 ICR 小鼠,戊Ba比妥钠麻醉后,采用椎板切除术暴露 T9-T10 处脊髓。然后采用脊髓打击器,于暴露脊髓处施加 90 kilodynes 的力造成挫伤型脊髓损伤,SCI 后连续 10 天每天肌肉注射庆大霉素(8mg/kg)防止术后感染,并每天两次人工膀胱按压挤尿直至恢复自主膀胱活动为止(防止尿潴留)。
处理一周后进行 BBB 评分评估小鼠后肢运动能力;
BBB score=0 时,则模型构建成功。将构模成功的小鼠分为两组,每组 8只,于挫伤型 SCI 处理 1week 后,于大鼠尾静脉处进行注射处理(模型组只注射生理盐水,治疗组注射含有受试药物的生理盐水 )。
SCI 后,16 只小鼠饲养 3week 时,根据SCI后 3 week 结果每组取 3 只效果最显著的小鼠取脊髓进行病理学检测,剩余 10 只小鼠继续饲养并与5week,7week,9week进行BBB 评分和机械触诱发痛检测。SCI后 9week 时所有受损脊髓中心进行冻存或 OCT 包埋。
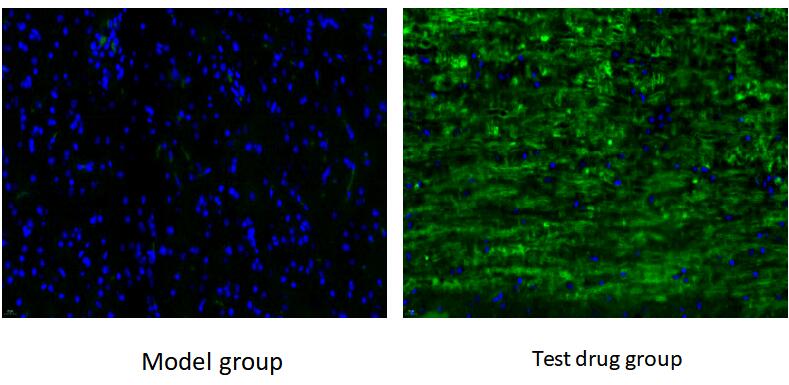
模型评价
1. BBB test
于药物注射后每隔一周进行 BBB test,直至移植后 8 周(即 SCI 后 3week、5week、7week、9week)。药物注射后 2 周(即 SCI 后 3week)共 16 只小鼠进行行为学检测数据,选择变化显著的 3 只小鼠(每组 3 只,即 6 只小鼠)的脊髓组织进行病理学检测。剩余 5 只小鼠(每组 5 只,即 10 只小鼠)依旧隔一周(即 SCI 后 5week、7week、9week)进行 BBB test。分值范围为0-21分,其中0分代表后肢完全失去运动功能,21分代表后肢运动功能基本正常。
2. Mechanical allodynia test (机械触诱发痛检测)
使用 Von Frey 测痛套件,记录缩足的压力(g),2 分钟时间间隔内测量 4 次,剔除最大值和最小值后获取的中间值作为痛阈(g)。
脊髓损伤模型的建立及术后小鼠情况:
所有实验小鼠在打击时均出现痉挛性摆尾,双下肢及躯体回缩扑动,随后双下肢瘫痪,损伤节段脊髓硬膜完整、出血、水肿。所有麻醉后小鼠于术后苏醒,出现双下肢瘫痪,运动、感觉功能丧失,依靠双上肢移动躯体,头颈部活动正常。术后1d,所有小鼠BBB评分均小于1分,活动明显减少,进食、饮水量减少,协助排尿7d后大部分小鼠恢复自主排尿功能。
机械触诱发痛检测:将小鼠置于金属网格的架子上使之适应环境,采用Von Frey丝自足底下方垂直剌激后爪底皮肤表面,能引起阳性缩爪反应所需的最低力度记为缩爪阈值,造模后小鼠的PWTs值较正常小鼠均下降。
组织病理学
3.免疫荧光
药物注射后两周,取受损脊髓组织,石蜡切片后,检测其中 MAP-1 的表达分布。
4.小胶质细胞/ 巨噬细胞检测— 激光共聚焦
药物注射后两周,取受损脊髓组织,石蜡切片后,检测其中 ED1(小胶质细胞/巨噬细胞活化 marker)。
需确认的信息
1. 模型种属(大鼠还是小鼠或是其他种属)
2. 动物体重有无要求,年龄有无要求
3. 雌雄有无要求
4. 模型构建具体方案
5. 取材要求(采血、取组织样本)
在线
咨询
殷女士18971342092
咨询热线
微信咨询